Ildiko Szabo: una molecola anticancro che lascia intatti i tessuti sani
Se tutti gli agenti chimici anticancro che vengono continuamente scoperti, e annunciati dai mezzi di informazione di massa, non fossero responsabili di diversi effetti collaterali sui tessuti sani dell’organismo che ospita la neoplasia da combattere, si disporrebbe oggi di un arsenale di farmaci antitumorali sicuro e completo, e il cancro probabilmente non sarebbe più quello spaventoso problema, che oggi ancora rappresenta, nonostante i notevoli progressi della ricerca degli ultimi decenni.

Ma la notizia che pubblichiamo oggi va letta con una attenzione decisamente diversa rispetto a tutte le altre che si sono prima viste o ascoltate sull’argomento: all’università di Padova, la professoressa Szabo, ordinario di Biochimica, ha sintetizzato con i suoi collaboratori, una nuova molecola, che, non solo è eccezionalmente efficace a largo spettro su molti tipi di tumori, ma che è già stata sperimentata in vivo in modelli murini, rivelandosi innocua. Fra i collaboratori sono da menzionare i gruppi della professoressa Paradisi del Dipartimento di Scienze Chimiche, del professor Semenzato del Dipartimento di Medicina, del dottor Zoratti dell’Istituto di Neuroscienze del Cnr, e due gruppi tedeschi capitanati rispettivamente da Erich Gulbins e Klaus Kalthoff.
Prima di illustrare il meccanismo di azione del principio attivo del possibile nuovo farmaco, è necessario però fornire qualche informazione di base, nel rispetto della comunicazione scientifico-divulgativa.
Da un miliardo e mezzo di anni a questa parte, le cellule eucariote (cioè quelle che compongono il nostro organismo, le quali, diversamente dalle cellule batteriche – procariote -, sono dotate di un nucleo provvisto di membrana nucleare) molto volentieri ospitano utilissimi organismi simili a unità protocellulari, che, con ogni probabilità, si sono nel lontano passato infilati al loro interno. Tra questi ex-procarioti autonomi ci sono i mitocondri, che sono di vitale importanza per le cellule del corpo. I mitocondri sono infatti gli organelli citoplasmatici, che riforniscono le cellule eucariote di tutta l’energia necessaria per svolgere le loro funzioni metaboliche, la più evidente delle quali si manifesta nell’attività delle miofibrille muscolari (cellule fuse insieme tra loro), che, contraendosi, consentono il movimento del corpo. Ma, naturalmente, energia è richiesta anche per la regolazione della temperatura corporea, e per una infinità di altre reazioni chimiche utili al metabolismo, che non possono avvenire appunto senza un contributo energetico.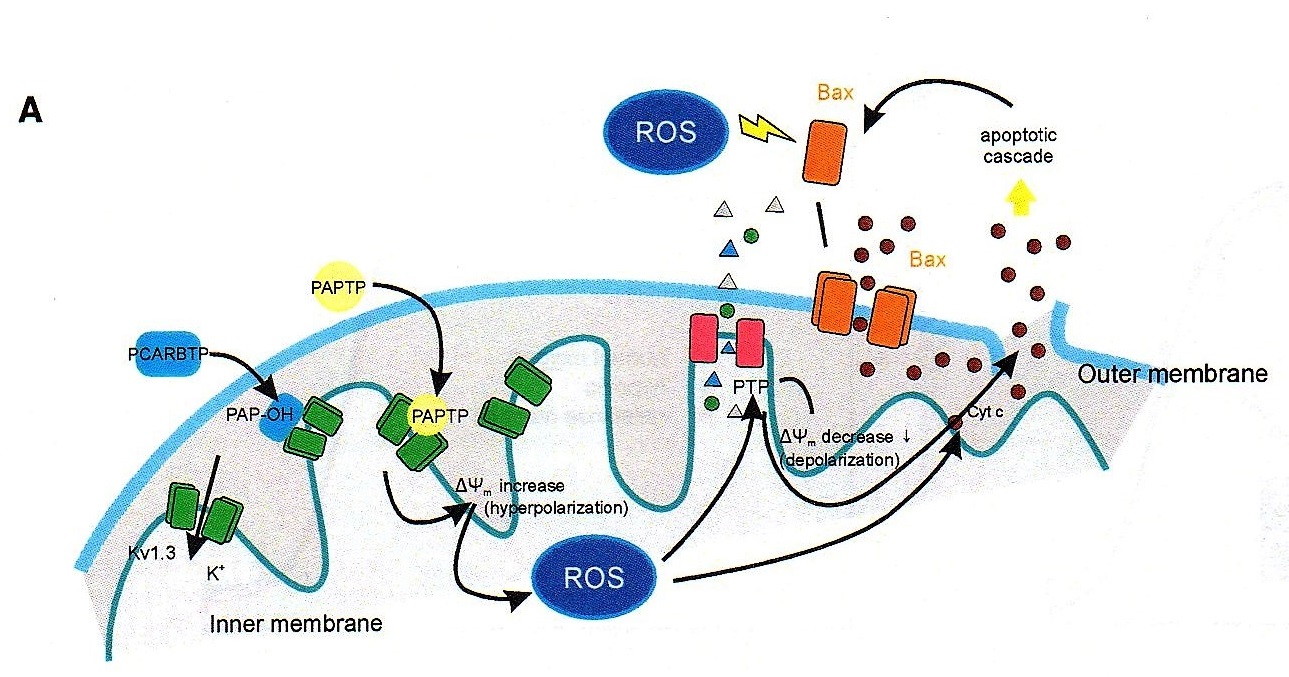
Si pensi, per esempio, all’energia chimica continuamente necessaria a trasportare atomi, ioni e molecole dentro e fuori le cellule, in senso contrario al gradiente di concentrazione. Ioni e molecole tendono infatti a diffondere naturalmente attraversando la membrana cellulare verso la parte in cui sono meno rappresentati, per cui le cellule devono consumare continuamente energia, al fine, per esempio, di mantenere il rapporto ideale tra il sodio e il potassio, che si trovano sia al loro interno, nel citoplasma, sia al loro esterno, nei liquidi interstiziali.
È il sodio, la cui concentrazione è sempre più alta all’esterno della cellula (e che perciò tende continuamente a entrare), il quale deve essere costantemente ributtato fuori, cosa possibile grazie alla presenza di un meccanismo chiamato “pompa sodio-potassio”. Gli ioni di potassio, vengono spinti nella cellula contro il loro stesso gradiente elettrochimico, e, avendo la stessa carica elettrica positiva di quelli del sodio, compensano in parte l’uscita di questi ultimi (due ioni di potassio entrano, e tre di sodio vengono espulsi). Per quanto riguarda la carica elettrica del terzo ione sodio da buttar fuori viene quindi richiesto un lavoro ancora maggiore.
Siccome all’interno del corpo degli organismi biologici la temperatura deve essere mantenuta intorno ai trentasette gradi 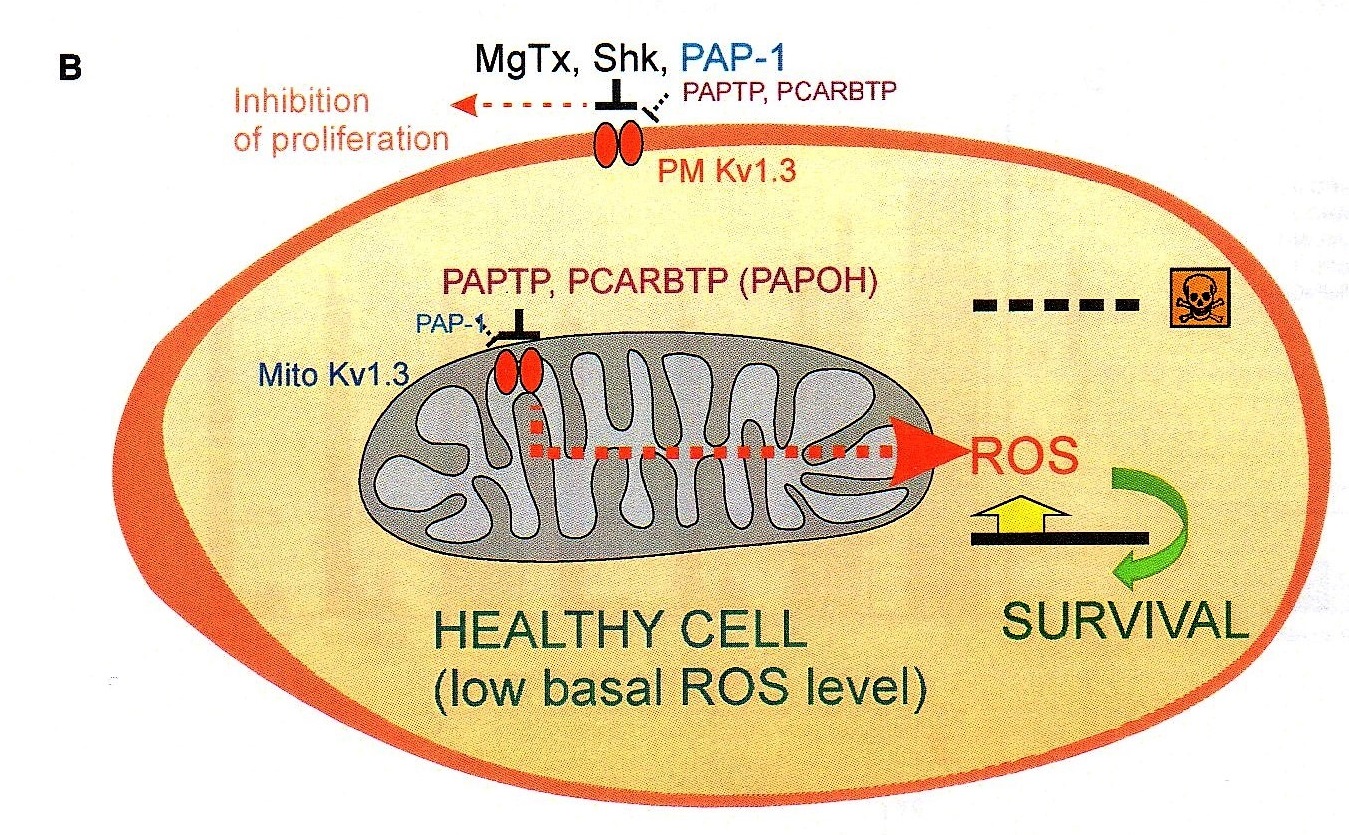 centigradi, al fine di non provocare danni ai tessuti, per fare in modo che le reazioni chimiche che richiedono energia possano avvenire, non si potrà quindi utilizzare calore. La natura ha selezionato allora strategie sorprendenti per la loro “intelligenza” e complessità, che consentono alle reazioni che necessitano di un apporto energetico, di avvenire senza bisogno di aumentare la temperatura dell’ambiente in cui si trovano.
centigradi, al fine di non provocare danni ai tessuti, per fare in modo che le reazioni chimiche che richiedono energia possano avvenire, non si potrà quindi utilizzare calore. La natura ha selezionato allora strategie sorprendenti per la loro “intelligenza” e complessità, che consentono alle reazioni che necessitano di un apporto energetico, di avvenire senza bisogno di aumentare la temperatura dell’ambiente in cui si trovano.
Per capire l’importanza della pompa sodio-potassio, si pensi che la diversità di concentrazione degli ioni sodio e potassio è utile alla cellula per mantenere costante la differenza di potenziale elettrico ai due lati della sua membrana; che tale differenza di potenziale serve alle cellule nervose per trasmettere il segnale sinaptico, oltre che (come in tutte le altre cellule) per consentire il trasporto di sostanze di importanza vitale, mantenere il volume cellulare, e, molto probabilmente, anche per respingere virus che tentassero di entrare al loro interno.
Ma la cellula dove prende quindi l’energia per provvedere indefessa al lavoro richiesto solo per conservare le condizioni minime necessarie? Ci pensano appunto i mitocondri. Tali organelli, infatti, sono provvisti di una splendida “catena di montaggio” deputata alla sintesi della molecola in grado di fornire l’energia utile a tutte le reazioni endoergoniche (che richiedono apporto energetico) che avvengono negli organismi biologici: l’adenosintrifosfato (ATP).
L’ATP, grazie alla cooperazione di altre molecole enzimatiche di supporto, rompe, infatti, quando necessario, uno dei suoi legami chimici ad alta energia, cedendola, al fine di consentire altre reazioni. L’ATP si trasformerà perciò in ADP (adenosindifosfato), liberando uno dei suoi tre atomi di fosfato inorganico. Sarà poi il mitocondrio a farsi carico di produrre nuovamente ATP, grazie alla sua complessa catena, a partire da ADP e fosfato inorganico (l’apporto energetico necessario per la ricostruzione dell’ATP deriverà qui dalla demolizione di molecole introdotte mediante la nutrizione).
Insomma, senza mitocondri la cellula eucariote muore. Ma i mitocondri possono invece assumere anche un’importanza cruciale per provocare, al contrario, la morte della cellula.
Nel lontano passato, la cellula, per fagocitare la protocellula destinata a dare poi origine ai mitocondri, l’ha avvolta con la propria membrana inglobandola. Durante l’evoluzione, tra cellula e mitocondri si è instaurato un felice rapporto: la ex-protocellula che si è venuta a trovare racchiusa in una vescicola delimitata dalla parte di membrana cellulare che l’ha avvolta per fagocitarla, ha organizzato la sua vita all’interno della cellula ospite, ma assunto anche un ruolo, che, col tempo si è rivelato indispensabile per quest’ultima, dando luogo al fenomeno della endosimbiosi.
In biochimica non era ancora chiara la natura delle cristae mitocondriali (le pieghe della membrana interna dei mitocondri, quella che, originariamente, apparteneva alle protocellule). Le cristae, infatti, analogamente alla membrana cellulare sono costellate da proteine di membrana: proteine dotate di una conformazione a spirale, le quali, affacciandosi da entrambi i lati delle membrane biologiche, consentono al loro interno il passaggio selettivo di ioni e molecole relativamente piccole, come, per esempio, quella del glucosio.
Se pori e canali proteici che attraversano la membrana cellulare erano già stati ampiamente studiati, e si conosceva ormai bene il loro ruolo selettivo nei confronti di ioni e nutrienti, restavano ancora da inquisire in dettaglio i canali che attraversano la superficie delle creste contenute nei mitocondri.
Le creste dei mitocondri (più scientificamente cristae), sono le pieghe della loro membrana interna, la quale, appartenendo alle antiche protocellule, nel momento in cui queste sono state fagocitate, si è dovuta adattare a uno spazio ristretto, ripiegandosi all’interno della membrana che invece apparteneva alla cellula che le ha avvolte e poi inglobate.
 “Stavamo studiando l’elettrofisiologia dei canali ionici mitocondriali, quando è emerso, anche da studi condotti da alcuni altri gruppi di ricerca, che nei mitocondri vi sono molti di tali canali, che risultano rigorosamente selettivi: alcuni sono permeabili solo al catione (ione positivo) del calcio, altri a quello del potassio, altri ancora all’anione (ione negativo) del cloro, e così via – confida a Scienzaveneto Ildiko Szabo, che, dopo la laurea a Budapest, è arrivata a Padova per il dottorato, cui è seguito un post-doc di due anni in Germania, successivamente al quale è tornata a insegnare all’ateneo Padovano ed è oggi ordinario di Biochimica – risultava però difficile capire quali geni codificassero per le proteine che sono responsabili della diversa attività selettiva dei canali mitocondriali (vi è infatti una notevole quantità di proteine che vengono prodotte fuori dal mitocondrio, ed è molto arduo quindi prevedere quali entrino poi a costituirne la microstruttura in un sito specifico): bisognava quindi iniziare a dare un nome a questi canali, e procedere alla loro identificazione molecolare”.
“Stavamo studiando l’elettrofisiologia dei canali ionici mitocondriali, quando è emerso, anche da studi condotti da alcuni altri gruppi di ricerca, che nei mitocondri vi sono molti di tali canali, che risultano rigorosamente selettivi: alcuni sono permeabili solo al catione (ione positivo) del calcio, altri a quello del potassio, altri ancora all’anione (ione negativo) del cloro, e così via – confida a Scienzaveneto Ildiko Szabo, che, dopo la laurea a Budapest, è arrivata a Padova per il dottorato, cui è seguito un post-doc di due anni in Germania, successivamente al quale è tornata a insegnare all’ateneo Padovano ed è oggi ordinario di Biochimica – risultava però difficile capire quali geni codificassero per le proteine che sono responsabili della diversa attività selettiva dei canali mitocondriali (vi è infatti una notevole quantità di proteine che vengono prodotte fuori dal mitocondrio, ed è molto arduo quindi prevedere quali entrino poi a costituirne la microstruttura in un sito specifico): bisognava quindi iniziare a dare un nome a questi canali, e procedere alla loro identificazione molecolare”.
Così, uno dei primi canali mitocondriali a venire identificato è stato il Kv1.3, e, nel 2008, la professoressa Szabo e i suoi collaboratori ne hanno realizzato un modello genetico per comprenderne il ruolo fisiologico.
È stato allora possibile porre in evidenza, e pubblicare sulla stampa scientifica internazionale l’importanza che tale canale riveste quando la cellula “decida” di autoeliminarsi (apoptosi).
L’apoptosi è il fenomeno della morte cellulare che viene autoprogrammata quando, per esempio, la cellula avverta di essere irrimediabilmente sotto il controllo di oncogeni, al fine di tentare di non produrre masse tumorali.
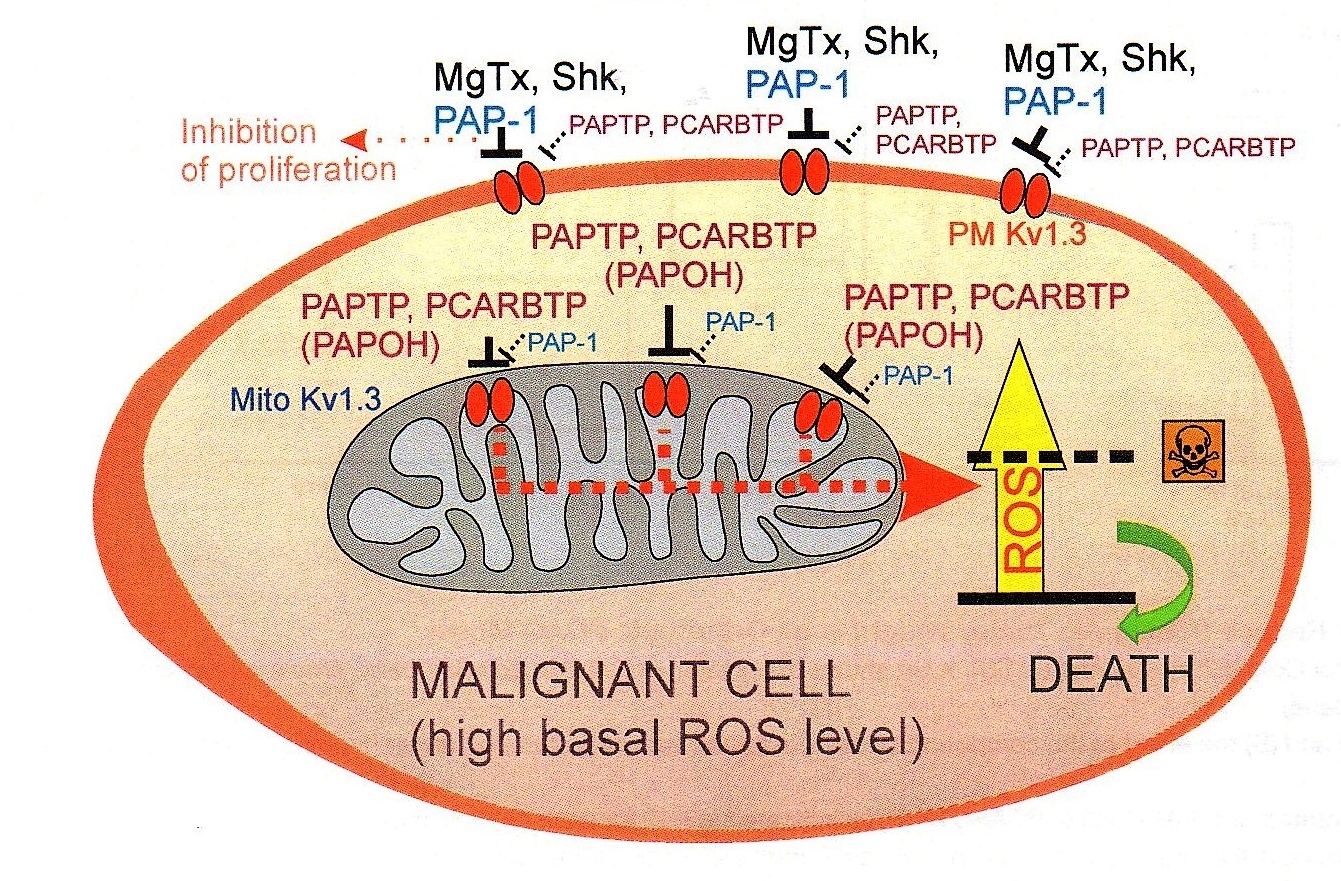
Szabo e Coll. hanno pensato di sfruttare le proprietà del Kv1.3 per arrivare a sintetizzare una sostanza che agisse direttamente su tale canale per indurre apoptosi, poiché spesso i sistemi apoptotici naturali della cellula tumorale non sono efficaci.
“Anche dalla letteratura – prosegue Ildiko Szabo – abbiamo infatti visto che questo canale è sovraespresso in molti tipi di tumore, e poi abbiamo capito che la sua inibizione, cambiando il potenziale di membrana blocca la respirazione mitocondriale, ma soprattutto induce la produzione di radicali liberi dall’ossigeno (ROS) con conseguente rapida apoptosi. Ed è molto importante sottolineare, che, nelle cellule normali, al contrario rispetto a quelle tumorali, vi sono invece pochi di questi canali, con una conseguentemente scarsa produzione di ROS. Inoltre, le cellule sane non sono comunque in uno stato Redox alterato (mentre in quelle cancerose si parte già da una più alta concentrazione ROS, i quali alterano lo stato Redox), e questo è un altro motivo per cui le cellule sane non soffrono quando si introduce il farmaco che blocca i canali Kv1.3”.
In sostanza mentre l’alterato metabolismo della cellula cancerosa già determina un aumento della concentrazione di ROS, l’ulteriore incremento della produzione di radicali liberi conseguente alla somministrazione del farmaco innesca il distacco del citocromo C (uno dei componenti della catena per la respirazione cellulare di cui è dotato il mitocondrio) e l’apertura di un poro da cui il citocromo esce. E quando il citocromo C esce dal mitocondrio, la cellula ha oltrepassato il punto di non ritorno e va inesorabilmente incontro all’apoptosi.
Il fatto di agire direttamente su un canale mitocondriale è di estrema importanza, perché l’apoptosi cellulare, è in genere innescata dal nucleo della cellula che avverte di essere minacciata, e inizia a sintetizzare molecole che appartengono al programma apoptotico, ma la cui azione può essere inibita da sofisticate strategie antiapoptotiche messe in campo dagli oncogeni. Analogamente la cellula tumorale è in grado di mettere in campo sistemi di autodifesa in risposta a diversi tipi di farmaci antitumorali. Strategie che invece vengono completamente bypassate quando viene somministrato il farmaco sintetizzato a Padova, che si dirige direttamente sul Kv1.3.
Tra le neoplasie che hanno già dimostrato di regredire in modo molto evidente in seguito alla sperimentazione della nuova molecola in modelli murini, vi sono diverse forme tumorali considerate in genere tra le più temibili e difficili da curare.
In particolare ha già dato ottimi risultati la sperimentazione in vivo su melanoma, sull’adenocarcinoma del dotto pancreatico (il famigerato Pdac, tristemente noto anche come killer silente, a causa del fatto che, essendo asintomatico, viene scoperto solo quando ha generato metastasi); per quanto riguarda la leucemia linfatica cronica si è sperimentato sul sangue di pazienti, e in vivo su topi, con risultati altrettanto soddisfacenti.
Per il Pdac si è sperimentato su cinque diverse linee cellulari, in cui si verificano di solito mutazioni a vari livelli, che le rendono resistenti ai comuni chemioterapici, mentre, andando proprio sul mitocondrio (vicino al meccanismo che induce il rilascio del citocromo C) si bypassano tutti gli eventi di segnalazione orientati a organizzare la resistenza alla chemioterapia tradizionale.
“Nella nostra sperimentazione in vivo abbiamo visto che sono invece sufficienti solo alcuni trattamenti perché le masse tumorali del melanoma (4 trattamenti) e del tumore pancreatico (10 trattamenti) si riducano più del 60% nel caso del PDAC e più del 90% nel caso del melanoma. Il nostro farmaco non è citotossico né cardiotossico (abbiamo effettuato controlli ECG sulle cavie dopo i trattamenti), né incide sul sistema immunitario, che soffre sempre molto con la chemioterapia poiché essa incide su tutti i tessuti a rapida riproduzione, come le cellule epiteliali, i leucociti e gli eritrociti. In particolare è molto importante che restino inalterati soprattutto i linfociti T, i quali rappresentano una importante difesa antivirale. Per la messa a punto della nuova molecola terapeutica abbiamo collaborato col dottor Mario Zoratti del nostro Cnr, molto esperto in fatto di farmacocinetica e drug design: le nostre sostanze dopo solo otto ore vengono espulse, e non si accumulano neanche nel cuore. Il farmaco può essere prodotto sotto forma liofilizzata, e il mio sogno ora è quello di arrivare al trial clinico” rileva infine Ildiko Szabo.



